| EGGE-WESER | Band 16 | Seiten 3-24 | 2004 |
Die Tagschmetterlings- und Widderchenfauna des Diemeltales
im Wandel der letzten 150 Jahre1
Thomas Fartmann
1 Einleitung
Die herausragende Bedeutung der Kalk-Halbtrockenrasen-Komplexe als Lebensraum für Tagfalter und Widderchen wird in Mitteleuropa von keinem anderen Habitattyp erreicht (vgl. Ebert & Rennwald 1991a, b; Kratochwil & Schwabe 2001, van Swaay 2002). Orchideenreiche Kalkmagerrasen zählen darüber hinaus gemäß der Fauna-Flora-Habitat-Richtlinie (FFH-RL; 92/43/EWG, Der Rat der europäischen Gemeinschaften 1992) zu den europaweit prioritär zu schützenden Lebensraumtypen (vgl. Ssymank et al. 1998, Fartmann et al. 2001).
Kalkmagerrasen haben im Diemeltal gegenwärtig noch eine Ausdehnung, wie sie sonst nahezu nur aus Süddeutschland bekannt ist (z. B. Schwäbische oder Fränkische Alb [vgl. Quinger et al. 1994, Beinlich & Plachter 1995, Schumacher et al. 1995]). Zugleich stellt das Diemeltal das letzte größere und zusammenhängende Kalkmagerrasengebiet im Nordwesten Deutschlands dar (s. Abb. 1 in Schumacher et al. 1995). Das Diemeltal ist bedingt durch die Großflächigkeit der Magerrasen und die Lage im Regenschatten des nach Westen vorgelagerten Eggegebirges bzw. Rheinischen Schiefergebirges, trotz der Lage im Norden Deutschlands, durch eine außergewöhnlich artenreiche Tagschmetterlings- und Widderchenfauna gekennzeichnet (Retzlaff 1973, 1975; Weigt 1982).
Die Magerrasen-Komplexe des Diemeltales verdanken ihre Entstehung einer jahrhundertelangen Nutzung als Hudelandschaft (Curtze 1850, Siebers 1911, Brökel 1984, Breder & Schubert 1993, Wilke 1996). Für das Diemeltal ist wie für weite Teile Mitteleuropas ein dramatischer Rückgang der Magerrasenfläche in den letzten 150 Jahren zu beobachten (vgl. Quinger et al. 1994, Beinlich & Plachter 1995, WallisDeVries et al. 2002). Die Hauptursachen für diese Verluste sind vor allem das Brachfallen und die Aufforstung der Kalk-Halbtrockenrasen (vgl. Quinger et al. 1994, van Swaay 2002, WallisDeVries et al. 2002).
Die zunehmende Fragmentierung der Kalkmagerrasen und die fehlende Nutzung haben einen gravierenden Rückgang vieler Tierarten zur Folge. Dies gilt in besonderer Weise für Tagschmetterlinge und Widderchen (vgl. Bourn & Thomas 2002). Die Arten beider Tiergruppen sind durch eine mehr oder weniger stark ausgeprägte Metapopulationsstruktur2 gekennzeichnet (C. D. Thomas 1995, Settele & Reinhardt 1999) und somit in besonderer Weise von einer Verinselung der Habitate betroffen. Darüber hinaus ist ein hoher Anteil der Taxa auf frühe Sukzessionsstadien angewiesen, die aufgrund fehlender Störungen in den Magerrasen zunehmend verloren gehen (J. A. Thomas 1993, Thomas & Morris 1994, Bourn & Thomas 2002).
Aufbauend auf den Ergebnissen einer Dissertation über die Schmetterlingsgemeinschaften des Diemeltales (Fartmann 2002, i. Dr.) soll nachfolgend ein Überblick über die Tagfalter- und Widderchenarten des Diemeltales sowie deren Wandel im Laufe der vergangenen 150 Jahre unter dem Einfluß sich verändernder Nutzungsformen und Klimabedingungen gegeben werden. Vor dem Hintergrund dieser historischen Analyse werden Vorschläge für das weitere Management aus schmetterlingskundlicher Sicht für das Diemeltal gemacht.
2 Untersuchungsgebiet
2.1 Lage und naturräumliche Charakteristika
Das Untersuchungsgebiet (UG) liegt im nordrhein-westfälisch-hessischen Grenzgebiet nordwestlich von Kassel und umfaßt einen ca. 39 000 ha großen, durchschnittlich 5–10 km breiten Ausschnitt des Diemeltales. Die Längserstreckung beträgt ca. 70 km und reicht von der Diemeltalsperre bei Helminghausen im Südwesten bis kurz vor die Mündung der Diemel in die Weser bei Helmarshausen im Nordosten (vgl. Abb. 1). Die Meereshöhe nimmt nahezu kontinuierlich von Südwesten mit über 600 m NN nach Nordosten auf ca. 100 m NN ab.
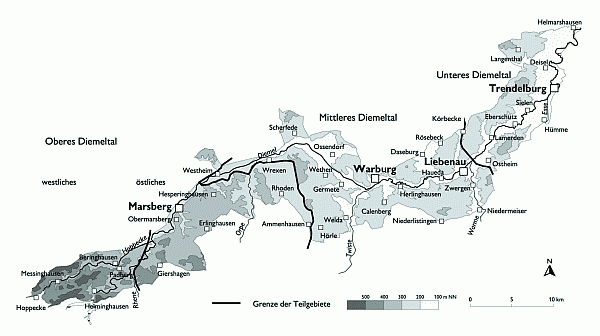
Abb. 1: Abgrenzung und Topographie des Untersuchungsgebietes
Der obere, südwestliche Abschnitt des UG liegt bis kurz vor Westheim auf nordrhein-westfälischem Gebiet (Hochsauerlandkreis), der untere, nordöstliche Teil etwa ab Eberschütz befindet sich dagegen in Hessen (Landkreis Kassel). Zwischen diesen beiden Orten liegen Teile sowohl auf nordrhein-westfälischem (Hochsauerlandkreis, Kreis Höxter) als auch auf hessischem Boden (Landkreis Waldeck-Frankenberg bzw. Kassel).
Aufgrund der starken physiogeographischen, insbesondere klimatischen Differenzierung erfolgt eine Unterteilung des UG in vier Abschnitte. Die Festlegung der in Abb. 1 dargestellten Grenzen orientiert sich primär an den Niederschlags- und Temperaturverhältnissen und sekundär an naturräumlichen Gegebenheiten. Von Südwesten nach Nordosten können unterschieden werden: das Obere Diemeltal mit einem westlichen und östlichen Abschnitt. Das westliche Obere Diemeltal umfaßt die hochgelegenen Oberläufe von Diemel und Hoppecke mit den höchsten Niederschlägen und geringsten Jahresmitteltemperaturen des gesamten UG.
Weiter flußabwärts an der Diemel folgt das um Marsberg gelegene und bereits deutlich mildere östliche Obere Diemeltal mit niedrigen Jahresmitteltemperaturen und hohen Niederschlägen.
Das Mittlere Diemeltal umfaßt den um Warburg gelegenen klimatischen Gunstraum mit relativ geringen Niederschlägen und hohen Temperaturen.
Östlich von Ostheim erstreckt sich beiderseits der Diemel das durch hohe Durchschnittstemperaturen, aber bereits deutlich ansteigende Niederschläge gekennzeichnete Untere Diemeltal.
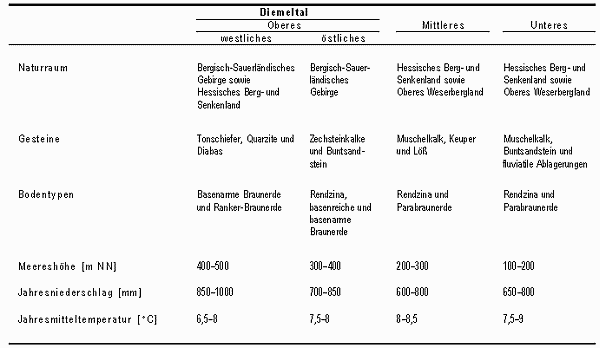
Eine zusammenfassende Darstellung wichtiger Charakteristika der vier Teilabschnitte ist Tab. 1 zu entnehmen. Detaillierte Darstellungen zu Geomorphologie, Geologie, Boden, Klima und potentieller natürlicher Vegetation sind in Fartmann (2002, i. Dr.) enthalten.
Tab. 1: Vorherrschende physiogeographische Charakteristika der Teilräume des Untersuchungsgebietes.
2.2 Historische Nutzung
Die historische Kulturlandschaft des Diemeltales des 18. und 19. Jh. war eine offene und waldarme Landschaft, wie aus Karten oder Texten hervorgeht (Brökel 1984, Brohl 1990, Nitsche & Bultmann 1995, Lucan & Eger 1996). Bis Mitte des 19. Jh. waren die Dörfer umgeben von Ackerfluren mit hofnahen Dung- und abgelegenen Außenfeldern, die im Rahmen der Dreifelderwirtschaft genutzt wurden (vgl. Budde & Brockhaus 1954). Weiter abseits der Dörfer oder auf flachgründigen Hängen lagen mit großem Flächenanteil die Hutungen. Die Wiesen befanden sich vor allem in den Flußauen und waren vermutlich vielfach dem Feuchtgrünland zuzuordnen. Die überwiegend lichten Waldungen wurden als Hude-, Mittel- oder Niederwälder genutzt. Zu diesem Zeitpunkt dürfte nahezu die gesamte Landschaft einen Lebensraum für Schmetterlinge dargestellt haben angefangen bei den Wäldern bis hin zu den Ackerflächen.
Zwischen 1830 und 1900 kam es im UG zu der unter dem Namen »Markenteilung«, »Separation« oder »Konsolidation« bekannten Umgestaltung des Besitzparzellengefüges (vgl. Brökel 1984). Die Allmenden wurden bei gleichzeitigem Ausbau des Wegenetzes zusehends aufgelöst und in Privatbesitz überführt. In den folgenden Jahrzehnten kam es schrittweise einerseits zur Intensivierung der Landnutzung im überwiegenden Teil des Offenlandes und andererseits zu geringeren Nutzungsintensitäten bzw. Umtriebszeiten innerhalb des Waldes. Dadurch sank der Anteil an für Schmetterlinge geeigneten Lebensräumen. Nach dem 2. Weltkrieg waren vermutlich der größte Teil des Ackerlandes und auch große Teile des Grünlandes im Diemeltal nur noch von untergeordneter Bedeutung als Lebensraum für Schmetterlinge. Die Schwerpunktlebensräume waren zu dieser Zeit sicherlich die trotz rückläufiger Tendenz ausgedehnten Magerrasen, das magere Grünland, Steinbrüche (die zu dieser Zeit auch neu entstanden) und die noch vorhandenen lichten Wälder. Feuchtes Grünland dürfte bereits damals nur noch eine untergeordnete Rolle im Diemeltal gespielt haben.
Die seit dem Beginn des 19. Jh. rückläufige Entwicklung der Magerrasen im Diemeltal läßt sich anhand der Schafbestände im Raum nachvollziehen: Von 1873 bis 1914 ging der Schafbestand in Hessen um 70 % zurück (Wilke 1996). Der Großteil der westfälischen Schafbestände entfiel auf den westfälischen Kernraum der Schafzucht auf Ostwestfalen (vgl. Gemmeke 1975). Konnten in Westfalen im Jahre 1864 noch ca. 636 000 Schafe gezählt werden, so sank der Bestand bis 1927 auf 83 000 Tiere. Sowohl in Hessen als auch in Westfalen erreichte die Schafzucht Mitte der 1960er Jahre ihren Tiefpunkt (Gemmeke 1975). Verbunden mit dem Rückgang der Schafbestände ist das Brachfallen großer Teile der Magerrasen im Diemeltal und deren Aufforstung mit Kiefern (Pinus sylvestris und Pinus nigra) (vgl. Schubert 1989a, Hozak & Meyer 1998). Diese Entwicklung hielt bis in die Mitte der 1980er Jahre an.
Seit Ende der 1980er Jahre wurde dem Rückgang der Magerrasen und den damit korrespondierenden geringen Schafbeständen im Diemeltal von Seiten des ehrenamtlichen und behördlichen Naturschutzes entgegen gewirkt. So wurden Entbuschungsmaßnahmen durchgeführt, Beweidungskonzepte erstellt und umgesetzt (Gerken & Meyer 1994, Schubert 1994, Hozak & Meyer 1998). Im Diemeltal stiegen die Schafbestände wieder an und die Nutzungsintensität auf den Magerrasen nahm zu.
3 Methoden
3.1 Vegetations-Komplexe
Als Komplex werden nachfolgend Flächen gefaßt, in denen ein Vegetationstyp dominiert und andere typische Kontakteinheiten mit geringerem Flächenanteil vorhanden sind. Auf das Beispiel der Kalkmagerrasen-Komplexe bezogen bedeutet dies, daß neben dem eigentlichen Kalkmagerrasen (Festuco-Brometea-Gesellschaften) auch magere Weiden und Wiesen (Molinio-Arrhenatheretea), typische Verbuschungsstadien (Prunetalia), lichte Waldbestände mit Kalkmagerrasenvegetation in der Krautschicht oder kleine Steinbrüche zum Komplex gestellt wurden. Die Erfassung der einzelnen Flächen erfolgte in den Jahren 1998–2000. Insbesondere bei den Kalkmagerrasen wurde versucht, alle Flächen im UG in Augenschein zu nehmen. Die Grundlage für die Suche nach den Flächen waren vorhandene Kataster (vgl. HGON 1987, Schubert 1989b, Projektgruppe Halbtrockenrasen 1993) oder die Angaben von Gebietskennern (Biermann mdl., Hozak mdl., Schulte mdl.). Nach der Abgrenzung im Gelände wurden die Flächen in einem Geographischen Informationssystem (ArcView 3.2) digitalisiert und die Flächenberechnungen durchgeführt. Insbesondere an steilen Hängen ist die tatsächliche Flächengröße größer als dies aus zweidimensionalen Karten zu ermitteln ist (vgl. auch Bruelheide 1992).
Bei Steinbruch-Komplexen wurden nur die unbewaldeten Steinbrüche berücksichtigt. Zu den Kalksteinbruch-Komplexen sind sowohl die Steinbrüche im Kalkgestein als auch in basisch verwitternden Diabasen zusammengefaßt worden.
3.2 Schmetterlinge
3.2.1 Bestimmung
Die Determination der Schmetterlinge erfolgte, sofern möglich, im Gelände. Zur Bestimmung diente das Werk von Wynhoff et al. (1992). Kritische oder nur anhand der Genitalien zu bestimmende Arten wurden getötet. In den Fällen, in denen die Artansprache nur anhand der Genitalmorphologie möglich war, dienten SBN (1987, 1997), Ebert & Rennwald (1991a, b), Brockmann & Thust (1993), Ebert & Lussi (1994), Hofmann (1994) und Feldmann et al. (1999) als Grundlage.
Colias alfacariensis und Colias hyale wurden im Imaginalstadium aufgrund fließender Übergänge nicht unterschieden (vgl. SBN 1987, Wynhoff et al. 1992). Beide Arten konnten aber anhand von Raupen- bzw. Eifunden und späterer Aufzucht getrennt werden.
Zur Determination der Raupen und Eier standen SBN (1987, 1997), Ebert & Rennwald (1991a, b), Hofmann (1994) und Weidemann (1995) zur Verfügung. Die Benennung der wissenschaftlichen Namen der Arten folgt Karsholt & Razowski (1996). Eine Ausnahme stellt die Gattung Ochlodes dar: hier dient Feldmann et al. (1999) als Grundlage. Für die deutsche Namensgebung wird auf Ebert & Rennwald (1991a), Ebert & Lussi (1994) und Hofmann (1994) zurückgegriffen.
3.2.2 Artenbestand und Verbreitung
Die Untersuchungen zum Artenbestand und zur Verbreitung der Tagschmetterlinge und Widderchen des Diemeltales erfolgten von April 1998 bis Oktober 2000. Hierbei wurden zwei Teilziele verfolgt:
1. Die Erfassung des Artenbestandes der Offenlandlebensräume und
2. die Kartierung der Verbreitung der Arten im Gebiet.
Insbesondere bei Arten, die generell in geringer Dichte fliegen, ist eine seriöse Beurteilung des Artenbestandes eines Raumes bzw. einzelner Flächen häufig nur durch eine Suche nach Präimaginalstadien (Eier bzw. Raupen) möglich (vgl. Hermann 1999). Vor diesem Hintergrund erfolgte neben der Beobachtung von Imagines, wenn möglich, auch oder sogar verstärkt die Suche nach Eiern und Raupen.
Während des Untersuchungszeitraumes wurden alle bekannten und für Schmetterlinge bedeutsamen Offenlandlebensräume (vgl. Kap. 3.1) mindestens einmal aufgesucht. Nach einer groben Einschätzung des potentiellen Arteninventars wurden die Flächen gegebenenfalls mehrfach, zu einem für den Nachweis wertgebender Arten (s. u.) günstigen Zeitpunkt, wieder kontrolliert. Anschließend erfolgte eine erfolgsorientierte Suche, das heißt, es wurde so lange gesucht, bis ein Nachweis erbracht wurde oder ein Vorkommen der Art mit hoher Wahrscheinlichkeit ausgeschlossen werden konnte. Als wertgebende Arten werden hier solche Taxa verstanden, die im Diemeltal ihre Arealgrenze erreichen bzw. auf Teilabschnitte des Diemeltales beschränkt sind oder eine hohe Gefährdungseinstufung aufweisen (vgl. Fartmann 2002, i. Dr.).
Neben den eigenen Beobachtungen flossen drei weitere Arten in die Betrachtungen zum Artenbestand des Diemeltales ein. So meldet Retzlaff (mdl.) jeweils Einzelnachweise von Melitaea athalia und Nymphalis polychloros seit 1998 aus dem Mittleren Diemeltal. Weigt (schriftl.) gibt Polyommatus bellargus für das Untere Diemeltal aus den Jahren 1979, 1989 und 2001 vom Hölleberg bzw. Bunten Berg mit Tagesbeobachtungen von 2–10 Faltern an. Auf dem Hölleberg (Angabe von 1979) fehlt die Raupennahrungspflanze Hippocrepis comosa zumindest gegenwärtig.
Probleme ergeben sich bei einigen alten Funden. Räumlich nicht exakt zuzuordnen sind alte Angaben zu Coenonympha tullia und Cupido argiades. Die Rundfunk-Angabe über den Fund eines Segelfalters aus dem Jahr 1970 im Mittleren Diemeltal gilt als nicht hinreichend gesichert (Retzlaff 1973). Große Probleme bereitet die Pyrgus alveus-Gruppe (vgl. Brockmann 1989, Brockmann & Kristal 1990). Ohne Belegstücke ist die Zuordnung der Angaben zu einer Art aus dieser Gruppe meist nicht möglich.
4 Ergebnisse und Diskussion
4.1 Heutige Nutzung und Vegetations-Komplexe
Nachfolgend soll auf die aktuelle Ausstattung und Nutzung der für die Tagschmetterlings- und Widderchenfauna relevanten Vegetations-Komplexe im Diemeltal eingegangen werden.
Der für die Schmetterlingsfauna mit Abstand bedeutsamste Lebensraumtyp sind die Kalkmagerrasen-Komplexe. Insgesamt sind aktuell 145 Kalkmagerrasen-Komplexe mit einer Gesamtfläche von ca. 750 ha im Diemeltal vorhanden (entspricht fast 2 % der UG-Fläche). Genutzte Flächen überwiegen mit ca. 410 ha (55 % Flächenanteil) leicht gegenüber brachliegenden mit etwa 340 ha (45 %). Unter den Nutzungsformen dominiert die Hütebeweidung mit Schafen und Ziegen, die sich auf ca. 290 ha erstreckt. Hierbei ist allerdings zu berücksichtigen, daß insbesondere auf größeren Flächen einzelne Partien kaum oder nur sehr unregelmäßig beweidet werden. Die Auswirkungen sind häufig denen der Brache ähnlich, und die effektiv beweidete Fläche dürfte deutlich geringer angesetzt werden als es die Werte suggerieren. Eine genaue Quantifizierung der exakten Beweidungsintensität ist für das gesamte UG nicht möglich. Deutlich hinter der Hütehaltung folgt mit einer Fläche von etwa 75 ha (10 % Flächenanteil) die Koppelhaltung von Schafen und insbesondere Ziegen. Von untergeordneter Bedeutung sind Pferde- und Rinderbeweidung sowie die Mahd als Pflegemaßnahme.Viele Flächen werden zudem mehr oder weniger regelmäßig mechanisch freigestellt.
Deutliche Unterschiede bestehen sowohl hinsichtlich Anzahl als auch Größe der Komplexe innerhalb der Teilabschnitte des UG. Der Schwerpunkt der Kalkmagerrasenverbreitung liegt im Unteren Diemeltal. Dieser Teil des UG ist durch eine große Zahl an Kalkmagerrasen gekennzeichnet, die zudem durch ihre Größe auffallen. Bei einer Fläche der Kalkmagerrasen-Komplexe von ca. 435 ha machen allein die beiden größten und unmittelbar aneinander grenzenden Komplexe des Hölle- und Stahlbergs bei Langenthal über 100 ha aus.Darüber hinaus sind weitere fünf Flächen über 20 ha und acht über 10 ha groß. Die Distanzen zu den nächstgelegenen Magerrasen sind mit meist weniger als 500 m gering. Der Anteil zwischen genutzten und ungenutzten Kalkmagerrasen entspricht ungefähr dem Durchschnitt des UG. Intensiv beweidete Flächen haben aber nur einen geringen Flächenanteil.
Das Mittlere Diemeltal weist ebenfalls eine Vielzahl von Kalkmagerrasen auf, doch sind die Flächen meist erheblich kleiner und stärker isoliert. Die 10-ha-Grenze wird nur von sechs Komplexen knapp überschritten. Die Gesamtfläche beläuft sich etwa auf 225 ha. Im Mittleren Diemeltal wird der Großteil der Kalkmagerrasen genutzt. Die Koppelhaltung ist auf diesen Teilabschnitt des UG und mit geringeren Anteilen auch auf das Untere Diemeltal beschränkt. Durch eine besonders regelmäßige und großflächige Hütebeweidung ist der Raum um Welda gekennzeichnet.
Im Oberen Diemeltal konzentrieren sich die Kalkmagerrasen auf drei Räume: die Zechsteinkalke um Westheim, die Zechsteinkalke östlich von Marsberg und die Massenkalke um Messinghausen. Die Kalkmagerrasen-Komplexe des östlichen Oberen Diemeltales haben eine Ausdehnung von etwa 85 ha, wobei drei Flächen knapp über 10 ha groß sind. Der überwiegende Teil der Flächen unterliegt einer regelmäßigen Hütehaltung mit Schafen und Ziegen.
Die Gesamtgröße der Kalkmagerrasen-Komplexe des westlichen Oberen Diemeltales beläuft sich auf etwa 5 ha. Sieht man von kleineren mit Rindern beweideten Partien ab, liegen alle Flächen brach. Die Kalkmagerrasen bei Messinghausen sind die höchstgelegenen des UG mit 380–530 m NN.
Silikatmagerrasen-Komplexe spielen im gesamten UG mit ca. 25 ha nur eine untergeordnete Rolle. Größere Vorkommen liegen nur im Oberen Diemeltal, insbesondere im westlichen Teil. Der überwiegende Teil der Flächen wird entweder mit Schafen oder mit Rindern beweidet. Eine Besonderheit des Raumes östlich von Marsberg (z. B. Wulsenberg und Hasental) ist die kleinräumige Verzahnung von Silikat- und Kalkmagerrasen.
Offene Kalksteinbruch-Komplexe nehmen 85 ha im UG ein und sind in allen Teilabschnitten des Untersuchungsraumes vertreten. Beweidung findet in den außerhalb der Kalkmagerrasen-Komplexe liegenden Steinbrüchen nicht statt. Die größeren Steinbrüche werden teilweise noch industriell genutzt.
Offene Silikatsteinbruch-Komplexe sind nur im Unteren Diemeltal mit geringer Flächenausdehnung (10 ha) vorhanden. Eine Nutzung erfolgt hier in aller Regel nicht.
Nach den Kalkmagerrasen-Komplexen sind die Magergrünland-Komplexe mit etwa 240 ha der flächenmäßig bedeutendste Lebensraumtyp für Schmetterlinge im Diemeltal. Die Hauptvorkommen des mageren Grünlandes liegen im westlichen Oberen Diemeltal. Das Verhältnis zwischen Brachen und beweideten Flächen ist nahezu ausgeglichen.
Wald macht ca. ein Drittel des Untersuchungsgebietes aus. Besonders hoch ist der Anteil des Waldes im westlichen Oberen Diemeltal; ansonsten sind die Wald-Komplexe gleichmäßig über das Gebiet verteilt. Die Waldbestände sind meist durch eine hohe Deckung der Kronenschicht gekennzeichnet und somit sehr dunkel. Ehemalige Hutungen innerhalb von Wäldern mit noch erkennbarer Hudewaldstruktur treten nur noch kleinflächig auf und sind größtenteils ohne Nutzung. Nicht mehr genutzte ehemalige Buchenniederwälder gibt es in größerer Ausdehnung im westlichen Oberen Diemeltal bei Messinghausen. Geschlossene Wälder bieten nur einer geringen Anzahl von Tagfaltern einen Lebensraum. Selbst die regelmäßig auf den flachgründigen Kalkstandorten stockenden und durch viele thermophile Pflanzenarten gekennzeichneten Carici-Fageten werden aufgrund des dichten Kronenschlusses kaum von Faltern genutzt (vgl. auch Meineke 1986). Der einzige Waldtyp der im Diemeltal einer Reihe von Tagfaltern einen Lebensraum bietet, sind lichte, mitunter häufig beweidete Kiefernwälder, die aus Aufforstungen hervorgegangen sind.
4.2 Schmetterlingsfauna im Wandel der Zeit
4.2.1 Arteninventar
In den vergangenen 160 Jahren wurden mindestens 104 Tagfalter- und Widderchenarten im Diemeltal nachgewiesen (vgl. Tab. 2). Dies entspricht einem Anteil von etwa 59 % der außerhalb der Alpen in Deutschland verbreiteten Taxa dieser Gruppen (vgl. Naumann et al. 1999, Reinhardt & Settele 1999). Mit aktuell 72 Arten zählt das Diemeltal zu den artenreichsten Landschaften im nördlichen Teil Deutschlands (vgl. z. B. Hattwig 1993, Binot 1996, Weber & Weidner 1995, Rengelshausen 1997, Glöckner & Fartmann 2003).
Zwischen den vier Teiluntersuchungsgebieten bestehen deutliche Unterschiede in der Gesamtzahl bislang beobachteter Arten: Der mit Abstand höchste Wert liegt für das Mittlere Diemeltal mit 99 Arten vor, gefolgt vom Unteren Diemeltal (75 Taxa), dem Ost- (73) und dem Westteil des Oberen Diemeltales (46). Die Zahlen sind primär ein Abbild der Erforschungsintensität in den Teilgebieten des UG; sie sind natürlich auch Hinweis auf die Klimaunterschiede. Nur das Mittlere Diemeltal um Warburg wurde seit der Mitte des 19. Jh. wiederholt und intensiv untersucht. Die anderen Teilabschnitte sind erst seit den 1970er Jahren (Unteres Diemeltal und Ostteil des Oberen Diemeltales) bzw. seit 1998 (Westteil des Oberen Diemeltales) Gegenstand intensiverer Studien. Mit Ausnahme des Mittleren Diemeltales müssen die Gesamtartenzahlen der letzten 160 Jahre deutlich höher angesetzt werden als dies die Zahlen widerspiegeln.
Tab. 2: Liste aller bislang im Diemeltal nachgewiesenen Tagfalter- und Widderchenarten.
Die Tabelle wurde wegen der Dateigröße ausgelagert!
Die aktuellen Artenzahlen der Teilgebiete sind dagegen ein Ausdruck der Anzahl, Flächengröße, Qualität und Vernetzung der für Schmetterlinge geeigneten Habitate sowie der klimatischen Verhältnisse. Mit 60 bzw. 61 Schmetterlingstaxa liegen das Mittlere und Untere Diemeltal etwa gleich auf. Es folgen der Ost- und Westteil des Oberen Diemeltales mit 53 und 46 Arten. Obwohl die Fläche der Kalkmagerrasen-Komplexe (wichtigster Lebensraum für Schmetterlinge) mit über 400 ha im Unteren Diemeltal fast doppelt so hoch ist wie im Mittleren Diemeltal (vgl. Kap. 4.1) und auch die Einzelflächen deutlich größer und besser vernetzt sind, halten sich die Artenzahlen in etwa die Waage. Die geringere Flächengröße und schlechtere Vernetzung der Habitate im Mittleren Diemeltal scheinen zumindest teilweise durch die Klimagunst des Raumes kompensiert zu werden. Darüber hinaus sind im Mittleren Diemeltal mit lichten Aufwuchswäldern und Kahlschlägen Stadien der Waldsukzession vorhanden, die Arten wie Erebia aethiops und Boloria euphrosyne als Lebensraum dienen und im Unteren Diemeltal fehlen. Arten, die auf die Großflächigkeit und gute Vernetzung von geeigneten Habitaten angewiesen sind, wie Pyrgus serratulae und Hipparchia semele, beschränken sich dagegen auf das Untere Diemeltal.
Die Abnahme der Artenzahlen vom Mittleren über das östliche und schließlich das westliche Obere Diemeltal korrespondiert mit der Abnahme der Klimagunst (höhere Niederschläge und geringere Jahresmitteltemperaturen) sowie der Größe der Magerrasen.
4.2.2 Artenwandel
Die Entwicklung des Artenbestandes im Diemeltal kann in verschiedene Phasen eingeteilt werden, die meist auf Veränderungen der Landnutzung und in abgeschwächter Form auf einen klimatischen Wandel zurückzuführen sind: Sehr früh setzte der Rückgang bzw. das Aussterben von Schmetterlingsarten der Feuchtgrünland-Komplexe ein. Arten wie Lycaena hippothoe oder Melitaea diamina, die aufgrund der geringen Verbreitung von Feuchtstandorten immer nur lokal, aber teilweise häufig vorkamen, werden von Uffeln (1908) zum letzten Mal genannt. Für die Ameisen-Bläulinge Maculinea nausithous und Maculinea teleius, für die das Diemeltal die nordwestliche Verbreitungsgrenze darstellte (vgl. Sonnenburg & Kordges 1997), liegen nur zwei Angaben von insgesamt drei Tieren aus Warburg im Jahre 1917 vor (Harkort 1975). Die Raupennahrungspflanze Sanguisorba officinalis kommt inzwischen nicht mehr in dem betrachteten Abschnitt des Diemeltales vor (vgl. Sonnenburg & Kordges 1997). Aufgrund der Zerstörung von Feuchtgebieten dürften die vier genannten Schmetterlingsarten bereits zu Beginn des 20. Jh. ausgestorben sein. Mit deutlichem zeitlichen Abstand – in den 1970er bis 1990er Jahren – folgten die weniger anspruchsvollen Arten Zygaena trifolii und Boloria selene (Retzlaff 1975, Biermann schriftl., Dudler schriftl., Geyer schriftl., Retzlaff schriftl., Weigt schriftl.). Hygrophile Schmetterlingsarten kommen gegenwärtig nicht mehr im Diemeltal vor.
Zur zweiten Faltergruppe, deren Arten meist nur bis zum Beginn bzw. zur Mitte des 20. Jh. nachgewiesen werden konnten, zählen Taxa, die im Diemeltal ihre nordwestliche Verbreitungsgrenze erreichten und von jeher sehr selten waren. Aussagen über einen direkten Zusammenhang des Artensterbens mit der Zerstörung ausgewählter Lebensräume bzw. klimatisch bedingten Veränderungen sind aufgrund der wenigen Angaben kaum möglich. Zu diesen nur vereinzelt nachgewiesenen Arten zählen Apatura ilia, Boloria dia und Cupido argiades (vgl. Ad. Speyer 1867, Uffeln 1926 bzw. Tab. 2).
Am stärksten ist der Artenschwund bei den Arten der Magerrasen-Komplexe. Durch den Rückgang der Schafbeweidung und die Nutzungsumwandlung der Magerrasen (vgl. Kap. 2.2) starben ehemals verbreitete bis häufige Arten wie Argynnis adippe, Melitaea cinxia oder die Arten des Pyrgus alveus-Komplexes bereits in der ersten Hälfte des 20. Jh. aus (Uffeln 1908, 1926). Die letzten sicheren Nachweise von Iphiclides podalirius stammen aus dem Jahre 1908 (Uffeln 1908). Bis in die 1970er Jahre konnten sich noch Chazara briseis, Lycaena tityrus, Polyommatus dorylas, Rhagades pruni und Zygaena lonicerae halten. Wenige Jahre später folgten Euphydryas aurinia und Aporia crataegi (vgl. Tab. 2).
Im Zusammenhang mit der Aufgabe der Dreifelderwirtschaft und des Anbaus der Esparsette (vgl. Kap. 2.2) steht das Aussterben von Polyommatus damon (vgl. auch Reuhl 1972). So schreibt Uffeln noch 1908 (S. 45) über die Art: »mit Vorliebe auf Esparsettenfeldern und sonnigen Berghalden«. Aus der nachfolgenden Zeit gibt es keine Meldungen mehr. Onobrychis viciifolia kommt im Diemeltal aktuell nur an wenigen Stellen und in geringen Beständen vor.
Nach den Arten der Magerrasen ist der größte Artenrückgang bei den Taxa der lichten Wälder (Hude-, Nieder- und Mittelwälder) zu verzeichnen. So reichen die letzten Nachweise von typischen Arten lichter Wälder wie Coenonympha hero, Glaucopsyche alexis oder Pyronia tithonus bis in das 19. bzw. den Beginn des 20. Jh. zurück (Ad. Speyer 1867, Uffeln 1926). Das Aussterben von Satyrium ilicis dürfte ebenfalls auf die veränderte Waldbewirtschaftung und damit den Rückgang lichter Wälder zurückzuführen sein (vgl. Hermann & Steiner 2000). Nach Ad. Speyer (1867) war die Art in manchen Jahren häufig. Uffeln (1908) fand Satyrium ilicis bei Welda im Mittleren Diemeltal öfter. Danach wurde die Art nicht mehr für das Diemeltal genannt.
Für eine Reihe von Arten ist ein Rückzug aus der kollinen in die submontane Stufe in den letzten 150 Jahren im Diemeltal zu beobachten. Mit Ausnahme von Erebia medusa waren Adscita statices, Argynnis niobe, Carcharodus alceae, Erebia ligea, Leptidea sinapis/reali, Lycaena virgaureae und Lasiommata maera im tiefgelegenen Mittleren bzw. Unteren Diemeltal immer schon selten (Ad. Speyer 1867, Uffeln 1908). Argynnis niobe konnte bis zum Beginn des vergangenen Jahrhunderts im Diemeltal nachgewiesen werden (vgl. Tab. 2). Lasiommata maera ist aus dem wärmebegünstigten Mittleren Diemeltal bis 1908 bekannt (Uffeln 1908). Im höhergelegenen Oberen Diemeltal konnte sich die Art dagegen bis 1985 halten (Legge schriftl.). Für die aktuell noch im Gebiet vorkommenden Arten Adscita statices, Carcharodus alceae, Erebia ligea, E. medusa, Leptidea sinapis/reali und Lycaena virgaureae lässt sich ebenfalls ein Rückzug in das Obere Diemeltal feststellen. In Abhängigkeit von der jeweiligen Art dürften mal Veränderungen der Lebensräume und mal klimatische Gründe (Temperaturzunahme; vgl. Parmesan et al. 1999) eine Rolle spielen.
Wie für weite Teile Westdeutschlands liegen die letzten Nachweise von Pontia daplidice im UG lange zurück (s. Brockmann 1989, Brockmann & Hild 1991, Ebert & Rennwald 1991a, Schulze 1995). Uffeln (1908) erwähnt die Art letztmalig für das Diemeltal. Angaben zu möglichen Ursachen für den Rückgang dieser Art macht Brockmann (1989).
Limenitis populi wurde letztmalig 1986 im Unteren Diemeltal beobachtet (Weigt schriftl.). Nymphalis antiopa konnte 1995 und 1996 erstmals nach langer Zeit wieder im Diemeltal festgestellt werden (Kinkler 1996, Schulze 1996). Die Nachweise lassen sich durch Einflüge nach Nordwesteuropa erklären (Schulze 1996); neuere Funde fehlen.
Neben dem auffälligen Rückzug oder Aussterben einzelner Arten sind im vergangenen Jahrhundert nachweislich mehrere Arten neu eingewandert. Abgesehen von zwei Exemplaren von Araschnia levana aus dem Mittleren Diemeltal bei Herbsen im Jahre 1867 (Ad. Speyer 1867) ist von einer Besiedlung des Diemeltales durch das Landkärtchen erst ab den 1930er Jahren auszugehen. So führt Uffeln (1908, 1914, 1926) Araschnia levana gar nicht für den Warburger Raum an. Aus den 30er Jahren des 20. Jh. ist für Hessen allerdings eine Einwanderungswelle nachgewiesen (Reuhl 1973, Brockmann & Hild 1991).
Die ersten Beobachtungen von Zygaena carniolica stammen vom Weldaer Berg (Mittleres Diemeltal) aus dem Jahre 1969 (Retzlaff 1972). Inzwischen tritt das von Südosten eingewanderte Esparsetten-Widderchen in nahezu jedem Meßtischblatt-Quadranten auf.
Die ersten Nachweise von Melitaea aurelia stammen vom Scheffelberg im Mittleren Diemeltal aus dem Jahre 1990 (Hozak mdl.). In der Folgezeit hat die Art große Teile des Unteren und Mittleren Diemeltales besiedelt. Auch diese Art ist aus südöstlicher Richtung eingewandert (vgl. Grünwald 1988).
Finke (1998) konnte weiterhin Jordanita subsolana neu für das Diemeltal nachweisen. Durch eigene Suche gelang der Fund von zwei weiteren besiedelten Habitaten. Da ein Nachweis über Imagines sehr schwierig ist, kann die Art vorher durchaus übersehen worden sein.
Eine Wiederbesiedlung des Diemeltales läßt sich für Aricia agestis belegen. Die Art war zu Beginn des 20. Jh. im Mittleren Diemeltal häufig (Uffeln 1908). Aus den 1970er Jahren werden schließlich nur zwei Einzeltiere gemeldet (Retzlaff 1981). Für den Zeitraum von 1980 bis 1995 fehlen Meldungen. Nachdem die Art 1996 durch Gottschalk (schriftl.) im Unteren Diemeltal wiedergefunden wurde, setzte bis zum gegenwärtigen Zeitpunkt eine rasante Ausbreitung bis in die Randbereiche des Oberen Diemeltales ein (Fartmann et al. 2002). Sowohl bei Melitaea aurelia als auch Aricia agestis dürften die warmen bis heißen Jahre des letzten Jahrzehnts des 20. Jh. ein entscheidender Grund für die Nordwestausbreitung gewesen sein (vgl. auch Parmesan et al. 1999).
Durch Einzeltiere konnten Zygaena loti im Jahr 1974 (Retzlaff 1975), Polyommatus thersites 1983 (Dudler schriftl.) und Satyrium w-album 1999 (eig. Beob.) neu für das Gebiet nachgewiesen werden.
4.2.3 Aktuelle Verbreitung im Diemeltal
Nachfolgend sollen die Arten näher vorgestellt werden, die in ihrer Verbreitung auf das Mittlere und Untere bzw. das Mittlere Diemeltal beschränkt sind. Bezüglich der Arten, die nur im Oberen oder Unteren Diemeltal vorkommen, sei auf Fartmann (2002, i Dr.) verwiesen.
Die folgenden 31 Arten (gut 40 % des Arteninventars) kommen gegenwärtig in nahezu jedem Messtischblatt-Quadranten des Diemeltales vor: Aglais urticae, Anthocharis cardamines, Aphantopus hyperantus, Araschnia levana, Callophrys rubi, Carterocephalus palaemon, Coenonympha arcania, C. pamphilus, Erynnis tages, Gonepteryx rhamni, Inachis io, Maniola jurtina, Melanargia galathea, Ochlodes sylvanus, Papilio machaon, Pararge aegeria, Pieris brassicae, P. napi, P. rapae, Polygonia c-album, Polyommatus icarus, Pyrgus malvae, Spialia sertorius, Thymelicus acteon, T. sylvestris, Vanessa atalanta, V. cardui, Zygaena carniolica, Z. filipendulae, Z. purpuralis und Z. viciae.
Arten des Mittleren und Unteren Diemeltales
Mit Aricia agestis, Lasiommata megera, Maculinea arion, M. rebeli, Melitaea aurelia und Satyrium spini sind Arten zusammengefaßt worden, die auf das sommerwarme und wintermilde Mittlere und Untere Diemeltal beschränkt sind (vgl. Abb. 2 und 3). In aller Regel handelt es sich um Arten, denen auch in der Literatur eine Präferenz für Wärmegebiete bescheinigt wird (vgl. Ebert & Rennwald 1991a, b; Weidemann 1995). Bei einigen der Arten dürfte darüber hinaus der Flächenausdehnung und Vernetzung der Habitate eine zusätzliche Bedeutung für das Verbreitungsbild zukommen. Wie aus der hohen Anzahl von Arten in dieser Gruppe ersichtlich wird, stellt die Grenze zwischen dem Oberen und Mittleren Diemeltal auch eine markante faunistische Scheidelinie dar. Vier der fünf Arten dieser Gruppe erreichen im Diemeltal ihre nordwestliche Arealgrenze (vgl. Fartmann 2002, i. Dr.). Nur Lasiommata megera kommt über das Diemeltal hinaus weiter westlich vor. Der Verbreitungsschwerpunkt der genannten Arten liegt allerdings im Unteren Diemeltal mit den großflächigen und in enger räumlicher Nähe stehenden Kalkmagerrasen.
Maculinea arion und Lasiommata megera kamen bis Mitte der 1970er bzw. 1980er Jahre auch im Oberen Diemeltal bei Marsberg vor (Weigt schriftl., Legge schriftl.). Maculinea arion stellt im Diemeltal – wie auch in weiten Teilen West- und Nordeuropas – hohe Ansprüche an ein trocken-heißes Mikroklima (vgl. z. B. J. A. Thomas 1995, 1996; J. A. Thomas et al. 1998). Diese Bedingungen sind nur auf kurzrasigen und somit intensiv beweideten Kalkmagerrasen erfüllt. Die Ursache für dasAussterben von Maculinea arion in den Marsberger Triftendürfte vor allem in der unregelmäßigen bzw. fehlenden Nutzung in den 1980er Jahren liegen.
Nur für wenige Arten ist der Rückgang im Diemeltal so deutlich dokumentiert wie für Maculinea arion. Die Art ist von vielen ehemaligen Flugplätzen – insbesondere im Mittleren Diemeltal – verschwunden (vgl. Uffeln 1908, Retzlaff 1973). Teilweise wurden die Habitate aufgeforstet (z. B. Schalkstal bei Welda) oder es gab Nutzungspausen (z. B. westfälischer Teil des Ibergs bei Welda). Sechs der zehn aktuellen Vorkommen werden als Hutung bzw. Koppel intensiv beweidet. Die übrigen Hänge sind sehr steil und schotterreich (größtenteils Gentiano-Koelerietum typicum in der schotterreichen Ausbildung) und weisen trotz fehlender Nutzung nur eine geringe Sukzessionsschwindigkeit auf.
Über den Rückgang von Lasiommata megera kann nur spekuliert werden. Von hoher Bedeutung scheint für die Art eine reich strukturierte Landschaft mit magerem Grünland und Magerrasen, Felsklippen, Zäunen, Erdanrissen und offenen Bodenstellen zu sein (vgl. auch Dennis 1983a, Weidemann 1995). Diese Bedingungen werden im Unteren Diemeltal mit seinen extensiv genutzten Kalkmagerrasen noch recht gut erfüllt, wohingegen im Mittleren Diemeltal die Landschaft weniger kleinteilig strukturiert ist und auch Magerrasen einen geringeren Anteil einnehmen.
Satyrium spini ist in den Kalkmagerrasen mit häufigerem Vorkommen der Wirtspflanze Rhamnus cathartica (verbuschtes Gentiano-Koelerietum, Prunetalia-Gesellschaften) vom Unteren bis ins Mittlere Diemeltal bei Welda zu finden. Ein Rückgang kann im Vergleich mit alten Daten ausgeschlossen werden (z. B. Ad. Speyer 1867, Uffeln 1908). Eine Aussage über die Zunahme der Art kann nicht gemacht werden, da die Nachweiswahrscheinlichkeit in der eigenen Studie vor allem aufgrund der Raupensuche deutlich höher ist.
Das heutige Verbreitungsgebiet von Aricia agestis im Diemeltal dürfte genauso groß oder größer sein, als dies vor 100 bzw. 150 Jahren der Fall war (vgl. Ad. Speyer 1867, Uffeln 1908). Die Art besiedelt vor allem Kalkmagerrasen (Gentiano-Koelerietum trifolietosum und typicum) mit Vorkommen von Helianthemum nummularium ssp. obscurum, aber auch magere Weiden (Lolio-Cynosuretum) oder Steinbrüche und Schlagfluren mit Geranium-Arten. Im Gegensatz zu Melitaea aurelia werden auch kleinste und stark isolierte Flächen besiedelt.
Melitaea aurelia tritt vor allem in großflächigen Kalkmagerrasen auf. Die Schwerpunktlebensräume sind hier das extensiv genutzte und nicht zu stark verfilzte Gentiano-Koelerietum mit viel Plantago media und gutem Blütenangebot.
Das Siedlungsgebiet von Maculinea rebeli konzentriert sich auf das Diemeltal zwischen Sielen und Liebenau. Biermann (2000) vermutet, daß die Art erst nach 1920 in das Diemeltal um Warburg eingewandert ist, da Uffeln (1908, 1914, 1926) den Kreuzenzian-Ameisenbläuling nicht meldet. Uffelns Exkursionsgebiet endete aber bei Liebenau und Listingen (vgl. z. B. Uffeln 1908), also genau dort, wo die heutigen Populationen beginnen. Es ist somit denkbar, daß die Art seit noch längerer Zeit im Gebiet bodenständig ist. Deutliche Lebensraumverluste sind bei diesem Ameisen-Bläuling bislang nicht zu beobachten. Maculinea rebeli besiedelt im Diemeltal verbuschte bis leicht verbuschte Kalkmagerrasen (Gentiano-Koelerietum trifolietosum und typicum) mit Vorkommen von Gentiana cruciata. Die einzelnen Habitate sind mitunter sehr klein (deutlich unter 1 ha) und teilweise stark isoliert.
Arten des Mittleren Diemeltales
Boloria euphrosyne und Erebia aethiops sind in ihrem Vorkommen ganz auf das Mittlere Diemeltal beschränkt (vgl. Abb. 4) und erreichen hier ihre westliche bzw. nordwestliche Verbreitungsgrenze Fartmann 2002, i. Dr.). Beide Arten wurden in früherer Zeit vor allem aus den Waldgebieten südwestlich von Warburg gemeldet (vgl. Ad. Speyer 1867, Uffeln 1908, Retzlaff 1973). Neu sind die Funde von Boloria euphrosyne um Zwergen. Das Vorkommen beider Arten hängt stark von der Form der Waldbewirtschaftung ab. Boloria euphrosyne ist auf Bestände mit Viola-Arten über schütter bewachsenem Boden im Wald oder am Waldrand als Larvalhabitat angewiesen (vgl. Warren & Thomas 1992, Greatorex-Davies et al. 1992). Solche Bedingungen sind vor allem auf Kahlschlägen realisiert, die im Gebiet allerdings sehr selten sind. Erebia aethiops besiedelt im Diemeltal ungenutzte, reichstrukturierte und lichte Kiefernwälder des Erico-Pinion (vgl. auch Hölzel 1996) sowie lichte Aufforstungen auf flachgründigen Kalkstandorten. Sowohl die für Boloria euphrosyne als auch für Erebia aethiops skizzierten Habitate haben in der »modernen« Forstwirtschaft (sogenannter »naturnaher Waldbau«) keinen Platz, entsprechend selten sind die Falterarten im Gebiet. Für beide Arten liegt ein deutlicher Rückgang vor, obwohl dies anhand des Vergleichs der aktuellen und historischen Fundpunkte nicht sofort deutlich wird. In der alten Literatur werden beide Taxa – im Gegensatz zu heute – zumeist als häufig angegeben (Ad. Speyer 1867, Uffeln 1908).
5 Vorschläge für das Management
Ergänzend zur aktuellen Nutzung lassen sich zunächst drei Kernforderungen für das weitere Management der Schmetterlingslebensräume im Diemeltal formulieren:
1. Ausdehnung der genutzten Magerrasen,
2. Vergrößerung der Fläche extensiv
3. Öffnung der Wälder.
Die nachfolgenden Ausführungen sind entsprechend ihrer Dringlichkeit als Prioritätenkatalog für das Management der Schmetterlingslebensräume im Diemeltal zu verstehen. Ziel aller Maßnahmen muß es sein, Sukzessionsabläufe immer wieder neu anzukurbeln und eine Redynamisierung der Landschaft zu erreichen (vgl. Finck et al. 1998). Für jeden der drei oben genannten Habitat-Komplexe werden Zielarten benannt. Zielarten sind nach Bernotat et al. (2002) die empfindlichsten und schutzbedürftigsten Arten eines Anspruchstyps. Durch Optimierung ihrer Lebensräume werden indirekt andere habitattypische Arten gefördert.
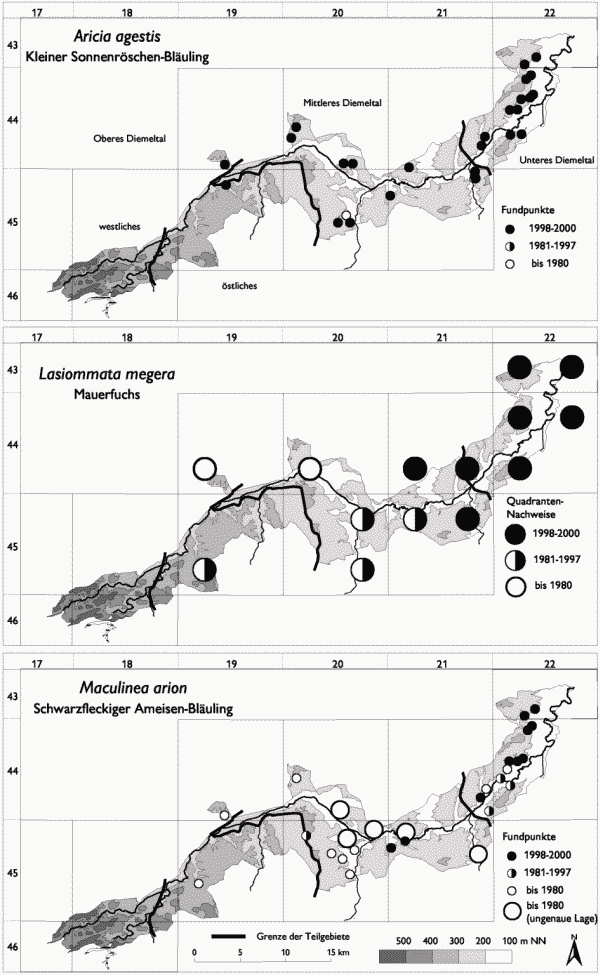
Abb. 2: Verbreitung von Tagfalter- und Widderchenarten, die in ihrem Vorkommen auf das Mittlere und Untere Diemeltal beschränkt sind (Teil 1). Aktuelle Daten: eig. Erhebungen; historische Daten: s. Fartmann (2002, i. Dr.).
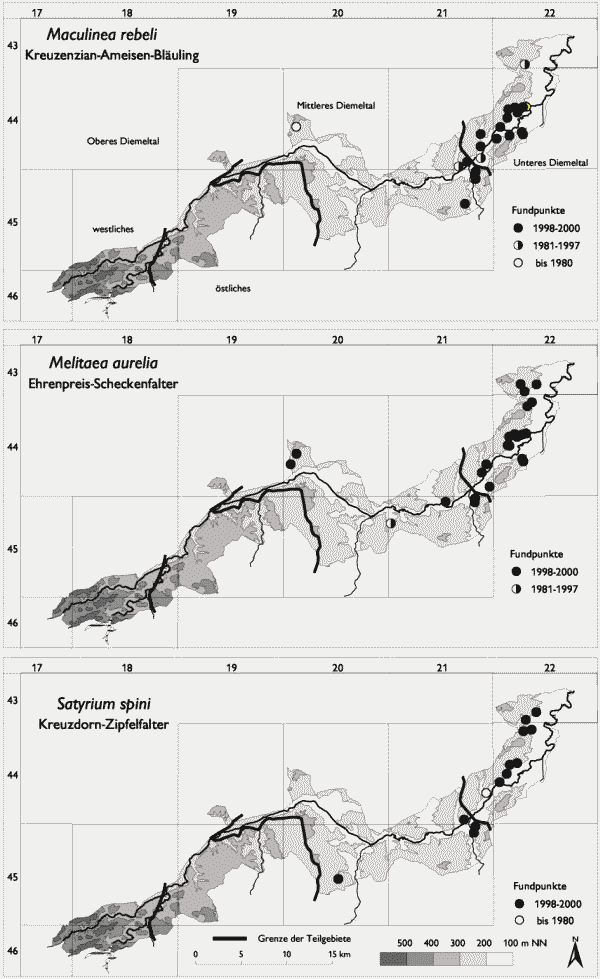
Abb. 3: Verbreitung von Tagfalter- und Widderchenarten, die in ihrem Vorkommen auf das Mittlere und Untere Diemeltal beschränkt sind (Teil 2). Aktuelle Daten: eig. Erhebungen; historische Daten: s. Fartmann (2002, i. Dr.).
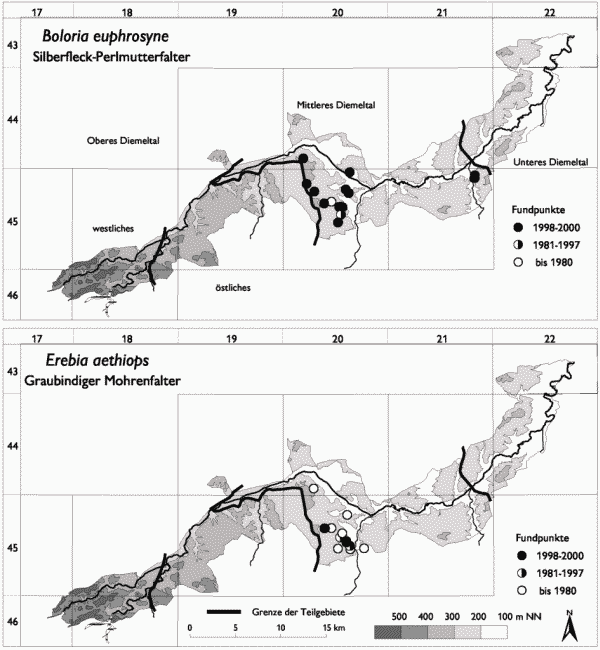
Abb 4: Verbreitung von Tagfalter- und Widderchenarten, die in ihrem Vorkommen auf das Mittlere Diemeltal beschränkt sind. Aktuelle Daten: eig. Erhebungen; historische Daten: s. Fartmann (2002, i. Dr.).
5.1 Ausdehnung der genutzten Magerrasen
Im gesamten Diemeltal ist eine Vergrößerung der genutzten Magerrasenfläche – sowohl auf Kalk- als auch auf Silikatuntergrund – anzustreben. Besonders dringlich ist dies für die ausgedehnten, teilweise schon seit Jahrzehnten brachliegenden Kalkmagerrasenflächen im Unteren und Mittleren Diemeltal zwischen Haueda und Sielen. Aufgrund des klüftigen Muschelkalks und der häufig steilen und südexponierten Hänge ist die Sukzessionsgeschwindigkeit zwar gering, dennoch scheint nach dem Aussterben von Chazara briseis Ende der 1970er Jahre bei weiterem Voranschreiten der Sukzession die ebenfalls auf rohboden- und schotterreiche Kalkmagerrasen angewiesenen Arten Hipparchia semele, Maculinea arion und Pyrgus serratulae das gleiche Schicksal zu ereilen. Vordringlich gilt es, die Hänge, die gegenwärtig noch von diesen Zielarten (vgl. Tab. 3) besiedelt werden, wieder in eine Nutzung zu nehmen. Dies trifft auf die Papenbreite, den Sommerberg, den Bunten Berg und den Schwiemelkopf zu. Im nächsten Schritt sind die angrenzenden größeren Magerrasen ebenfalls in ein Nutzungskonzept zu integrieren.
Tab. 3: Habitat-Komplexe und deren Zielarten im Diemeltal.
| Habitat-Komplex | Zielarten |
| Magerrasen, genutzt | Hipparchia semele, Maculinea arion und Pyrgusserratulae |
| Magergrünland, extensiv genutzt | Erebia medusa |
| Wälder und Schlagfluren | Boloria euphrosyne, Erebia aethiops und E. ligea |
| Magerrasen, wirtschaftlich nicht sinnvoll nutzbar | Hamearis lucina und Maculinea rebeli |
| Steinbrüche | Hipparchia semele und Plebeius argus |
Neben der Restituierung der historischen Nutzung in brachliegenden Magerrasen ist eine Ausdehnung der Magerrasenfläche auf Kosten von Nadelholzforsten – insbesondere Kiefernforsten – auf ehemaligen Magerrasenstandorten im gesamten Diemeltal anzustreben. Dies gilt vor allem für steile, an bestehende Magerrasen angrenzende Südhänge.
Die bevorzugte Form der Nutzung ist die Hütehaltung mit Schafen (vgl. BUTT 1986, Schumacher 1991, Gerken & Meyer 1994, Beinlich & Plachter 1995, Hozak & Meyer 1998, Dolek 2000). Durch die Hütebeweidung kann in Abhängigkeit von der Hütetechnik ein heterogenes Mosaik von stark und weniger intensiv gestörten Abschnitten geschaffen werden. Die Koppelhaltung sorgt dagegen für eine stärkere Vereinheitlichung der Struktur. Ist eine Integration der Flächen in ein Hütebeweidungssystem nicht möglich, ist eine Beweidung in Koppelhaltung mit Schafen und/oder Ziegen gegenüber der Brache zu bevorzugen. So zählen z. B. die einmal jährlich für zwei bis drei Wochen als Ziegen-/Schafkoppel genutzten Flächen des Wiegenfußes und des Warmbergs bei Zwergen im Mittleren Diemeltal zu den artenreichsten Schmetterlingslebensräumen im Diemeltal. Ein Ausfall wertgebender Arten aufgrund der Nutzung ist hier nicht zu beobachten. Weitergehende Ausführungen zur Beweidung von Magerrasen sind der Literatur zu entnehmen (vgl. Schumacher 1991, 1995; Gerken & Meyer 1994, Michels & Woike 1994, Quinger et al. 1994, Woike & Zimmermann 1994, Fartmann & Mattes 1997, Hozak & Meyer 1998).
Schotterreiche Hänge, die als potentielle Habitate der Zielarten Hipparchia semele, Maculinea arionund Pyrgus serratulae in Frage kommen, sind einer scharfen Beweidung zu unterziehen, um die gewünschte kurzrasige bzw. lückige Struktur zu schaffen (vgl. Quinger et al. 1994). Da aufgrund der ökonomischen Perspektiven für die Schafhaltung von einer nicht annähernd vollständigen Beweidung der Kalkmagerrasen in der Zukunft auszugehen ist und für die Arten der rohboden- und schotterreichen Habitate im Diemeltal gegenwärtig das höchste Aussterberisiko besteht, ist für das Gros der zukünftig genutzten Flächen eine scharfe Beweidung zu fordern. Die Gefahr des Aussterbens von Arten der Brachflächen (z. B. Argynnis aglaja, Erebia medusa, Maculinea rebeli, Melitaea aurelia) aufgrund zu intensiver Nutzung ist im Diemeltal gegenwärtig nur bei Erebia medusa im Westteil des Oberen Diemeltales gegeben. In den Erebia medusa-Lebensräumen ist daher auf eine intensive Beweidung zu verzichten (s. u.).
In allen brachliegenden Magerrasen, die einer Nutzung zugeführt werden sollen, sind im Rahmen der Erstpflege mechanische Gehölzbeseitigungen durchzuführen. Die Gehölze sollten allerdings nicht, wie dies teilweise geschehen ist, auf der Fläche liegen bleiben (jüngst noch am Bunten Berg, Unteres Diemeltal) oder in den Säumen von größeren Gebüsch-Komplexen angehäuft werden (Dahlberg, Oberes Diemeltal). Zumindest auf größeren Magerrasen spricht nichts dagegen, die Gehölze an ein bis zwei Stellen aufzuschichten und zu verbrennen.
5.2 Vergrößerung der Fläche extensiv genutzten Magergrünlandes
Nahezu der einzige Lebensraumtyp mit großer Bedeutung für Tagschmetterlinge und Widderchen, bei dem keine deutliche Erhöhung der Nutzungs- und Störungsintervalle anzustreben ist, sind die Komplexe des mesophilen Grünlandes. Zunächst gilt es, die Fläche des mageren Extensivgrünlandes im Diemeltal – insbesondere im Oberen – auszuweiten. Da die Schmetterlingszönose des Magergrünlandes im Oberen Diemeltal – mit Erebia medusa als Zielart (vgl. Tab. 3) – stark an Brachebedingungen angepaßt ist, sind kontinuierliche Nutzungen zu vermeiden. Regelmäßig gehütete Flächen südlich von Rösenbeck (Egge), unmittelbar angrenzend an die Metapopulation von Erebia medusa am Sticklenberg, werden von der Mohrenfalterart gemieden. Mit dem Warzenbeißer (Decticus verrucivorus) tritt zudem eine weitere Insektenart am Sticklenberg auf (einziges Vorkommen im Diemeltal), die empfindlich auf intensive Beweidung reagiert (vgl. Fartmann 1997, Schuhmacher & Fartmann 2003). Der überwiegende Teil der Magergrünland- und Kalkmagerrasenbrachen um Messinghausen hat ein Alter von 10 bis 15 Jahren. Gegenwärtig scheinen viele noch in einem guten Zustand für Erebia medusa zu sein. Dennoch dürfte mit zunehmendem Alter der Brachen die Qualität für die Art und einige andere gefährdete Taxa der Magergrünlandbrachen durch zunehmende Verfilzung geringer werden. Ihre optimale Entfaltung haben die meisten wertgebenden Arten in jungen Brachen. Um einen Niedergang der Falterpopulationen zu verhindern, sind Störungen und Auflockerungen bzw. eine Vernichtung des Streufilzes notwendig. Vor diesem Hintergrund scheint die extensive Nutzung von einem Drittel der Flächen nach dem Ende der Eiphase (ca. 2–3 Wochen nach dem Ende der Flugzeit: Anfang bis Mitte Juli) in jährlich alternierendem Rhythmus geeignet. In Frage kommen sowohl eine Hütehaltung mit Schafen als auch eine Rinderbeweidung. Unter einer extensiven Beweidung ist eine Nutzung zu verstehen, bei der es aufgrund der Viehdichte und der Auftriebsdauer zur Ausbildung einer heterogenen Vegetationsstruktur kommt und nicht zu einheitlich kurz gefressenen Rasen, wie sie z. B. für Hipparchia semele und Maculinea arion wünschenswert sind.
5.3 Öffnung der Wälder
Eine wichtige Ansatzstelle für die Optimierung der Schmetterlingslebensräume im Diemeltal ist eine Öffnung der Wälder. Dies beinhaltet einerseits die Auflichtung von Laub- und Kiefernwäldern mit noch vorhandener Kalkmagerrasenvegetation in der Krautschicht und den Kahlschlag von Nadelholzforsten auf ehemaligen Kalkmagerrasen-Standorten innerhalb von Wald-Komplexen (z. B. Schalkstal bei Welda, Mittleres Diemeltal) andererseits. Vorrangiger Handlungsbedarf besteht hier in den Waldgebieten um Welda, des Eichholzes und des Quasts mit noch vorhandenen Populationen der Zielarten Boloria euphrosyne und Erebia aethiops (vgl. Tab. 3). Als Zielart der Schlagfluren im Oberen Diemeltal ist Erebia ligea zu nennen. Hier sind Optimierungsmaßnahmen um Padberg, Lüchtenberg und Arnstein anzustreben.
Für viele Tagfalterarten im Wald zieht Hochwaldnutzung und die naturnahe Waldbewirtschaftung mit Einzelstammentnahme das Aussterben nach sich. Die Auflichtungen und Störstellen im Wald sind viel zu klein, um die Ansprüche der Larval- und Imaginalstadien an Wärme und Nektarangebot zu befriedigen. Warren & Thomas (1992) nennen als Hauptgrund für den Niedergang der Populationen der Waldschmetterlinge in Großbritannien den Rückgang der Nieder- und Mittelwaldwirtschaft. Hiermit im Zusammenhang stehend und von gleicher Bedeutung war im Diemeltal sicherlich das Erlöschen der Waldweide (vgl. Kap. 2.2). Neben dem Rückgang der historischen Waldnutzungsformen und der Ausbildung von dunklen Hochwäldern kommt in jüngster Zeit der Verzicht auf die Kahlschlagwirtschaft hinzu. Die große Bedeutung von lichten Wäldern und Kahlschlägen ist nicht nur für Tagschmetterlinge und Widderchen nachgewiesen, sondern auch für andere Insektengruppen oder Vögel (vgl. Greatorex-Davies & Marrs 1992, Fuller 1992, Bolz 1999, Gatter 2000, Hermann & Steiner 2000).
Sofern möglich, ist in den genannten Gebieten eine Reetablierung von Nieder- und Mittelwäldern (vgl. Warren & Stephens 1989, Warren 1996) oder der Waldweide in aufgelichteten Wäldern anzustreben. Ist dies nicht realisierbar, werden allein durch den Kahlschlag der Nadelholzforsten auf potentiellen Magerrasenstandorten – auch ohne anschließende Nutzung – Sukzessionsstadien geschaffen, die in der heutigen Landschaft des Diemeltales selten sind und für Jahre bis Jahrzehnte für viele Schmetterlingsarten geeignete Bedingungen schaffen (Warren & Stephens 1989). Eine vergleichbare Bedeutung können auch Windwurfflächen erlangen, wenn sie nicht aufgeforstet werden.
5.4 Entbuschung kleiner oder sehr steiler und somit wirtschaftlich nicht sinnvoll zu nutzender Magerrasen
Viele Magerrasen sind sehr klein bzw. so steil, daß sie nicht sinnvoll in Beweidungssysteme zu integrieren sind. Dennoch kommt ihnen teilweise noch eine große Bedeutung als Lebensraum für seltene Falterarten zu. So kommen die Zielarten Hamearis lucina und Maculinea rebeli (vgl. Tab. 3) um Liebenau und Zwergen auf mehreren Kleinstflächen vor. Hier sind Entbuschungen durchzuführen und Vergrößerungen der Flächen zumeist auf Kosten von Kiefernforsten anzustreben.
5.5 Auflassen der Steinbrüche
Der überwiegende Teil der nicht mehr genutzten Steinbrüche befindet sich gegenwärtig in einem Sukzessionszustand, der weitestgehend den Ansprüchen von Plebeius argus entspricht. Da noch einige Steinbrüche in Betrieb sind, ist auch in Zukunft mit der Schaffung neuer Lebensräume für die Art zu rechnen. Die nördlichsten Vorkommen der Zippammer in Deutschland liegen ebenfalls in offenen Steinbrüchen im Hoppecketal bei Messinghausen. Damit die Zielarten Plebeius argus und auch Hipparchia semele die Flächen nach der Nutzungsaufgabe aber auch besiedeln können, dürfen diese nicht rekultiviert und müssen der Sukzession überlassen werden.
5.6 Bestehende Beweidungssysteme und Entbuschungsmaßnahmen
Neben den oben genannten prioritär umzusetzenden Maßnahmen gilt es zu reflektieren, wie wirksam die bestehenden Beweidungssysteme und die durchgeführten Entbuschungsmaßnahmen sind. Zunächst kann allen gegenwärtig im Diemeltal stattfindenden Management-Maßnahmen auf den Magerrasen eine positive bis sehr positive Wirkung auf die Schmetterlingsfauna bescheinigt werden. Dies gilt für Flächen, die in Hütehaltung beweidet werden, die als Schaf- oder Ziegenkoppel sowie als Rinderweide dienen bzw. die gemäht werden. In gleicher Weise trifft dies für die mechanische Gehölzbeseitigung zu. Nur sollte der Gehölzschnitt nicht, wie es teilweise zu beobachten war (s. o.), auf der Fläche verbleiben.
Auch der Einsatz der Freischneidemaschinen im hessischen Teil des Unteren Diemeltales bis hin zum Mittleren Diemeltal bei Zwergen ist zu begrüßen, da die Maschinen neben der Gehölzbeseitigung häufig zu Bodenverwundungen führen, die wiederum für viele Falterarten wichtige Störstellen darstellen (Fartmann 2002, i. Dr.).
Eine weitergehende Optimierung des Beweidungssystems ist für den Hölle- und Stahlberg anzustreben. Beide Flächen und die umgebenden Magerweiden werden zwar regelmäßig beweidet, die wenig ertragreichen Hänge aber weitgehend ausgespart. Zur Stabilisierung der Bestände der Rohbodenarten Hipparchia semele, Maculinea arion und Pyrgus serratulae ist eine schärfere Beweidung dieser Abschnitte anzustreben.
6 Literatur
Beinlich, B. & H. Plachter (Hrsg.) (1995): Schutz und Entwicklung der Kalkmagerrasen der Schwäbischen Alb. Beih. Veröff. Naturschutz Landschaftspflege Bad.-Württ. 83, 520 S.
Bergmann, A. (1952): Die Großschmetterlinge Mitteldeutschlands. 2. Tagfalter. Verbreitung, Formen und Lebensgemeinschaften. Jena (Urania-Verlag), 485 S.
Binot, M. (1996): Besiedlung und Nutzung urban beeinflußter Biotope durch tagaktive Schmetterlinge (Lepidoptera: Rhopalocera, Zygaenidae) im rechtsrheinischen Teil der Stadt Bonn. Dipl.-Arb., Universität Bonn. 133 S.
Bolz, R. (1999): Mittel- und Hudewälder als ein Leitbild für eine »natürliche« Waldform in Mitteleuropa. Natur- u. Kulturlandschaft, 3, 198–207.
Bourn, N. A. D. & J. A. Thomas (2002): The challenge of conserving grassland insects at the margins of their range in Europe. Biol. Cons. 104, 285–292.
Breder, C. & W. Schubert (1993): Pflege- und Entwicklungsplan für das Naturschutzgebiet »Auf der Wiemecke« bei Obermarsberg. Marsberg 93, 76–81.
Brockmann, E. (1989): Schutzprogramm für Tagfalter in Hessen (Papilionidea und Hesperioidea). Reiskirchen, 436 S.
Brockmann, E. & A. Hild (1991): Die Tagfalterfauna von Gießen im Wandel der Zeit. 1. Teil. Naturkunde u. Naturschutz Mittelhessen 2, 31–55.
Brockmann, E. & P. M. Kristal (1989): Die Arbeitsgemeinschaft Hessischer Lepidopterologen – ein Erfahrungs- und Sachstandsbericht. Nachr. entomol. Ver. Apollo, Frankfurt/Main, N. F. 10 (3), 263–272.
Brockmann, E. & R. Thust (1993): Bestimmungsschlüssel der mitteleuropäischen. nichtalpinen Pyrgus-Arten (Lepidoptera: Hesperiidae). Nachr. entomol. Ver. Apollo, Frankfurt/Main, N. F. 14 (3), 189–200.
Brohl, E. (1990): Ein Feldlager bei Erlinghausen. Marsberg 90, 174–178.
Brökel, G. (1984): Erlinghausen, eine Dorfgeschichte. Erlinghausen. 972 S
Bruelheide, H. (1992): Kartierung der Kalkmagerrasen im östlichen und westlichen Meißner-Vorland. Bot. Naturschutz Hessen, Beih. 4, 85–100.
Budde, H. & W. Brockhaus (1954): Die Vegetation des Südwestfälischen Berglandes. Decheniana 102 B, 47–275.
BUTT (Butterflies Under Threat Team) (1986): The management of chalk grassland for butterflies. Focus on Nature Conservation 17. Peterborough (Nature Conservancy Council), 80 S.
Curtze, L. (1850): Geschichte und Beschreibung des Fürstenthums Waldeck. Ein Handbuch für Vaterlandsfreunde. Arolsen (Speyer’sche Buchhandlung), 664 S.
Der Rat der Europäischen Gemeinschaften (1992): Richtlinie 92/43/EWG vom 21. Mai 1992 zur Erhaltung der natürlichen Lebensräume sowie der wildlebenden Tiere und Pflanzen. Amtsblatt der EWG L206, 7–50.
Dolek, M. (2000): Der Einsatz der Beweidung in der Landschaftspflege: Untersuchungen an Tagfaltern als Zeigergruppe. Laufener Seminarberichte 4, 63–77.
Ebert, G. & E. Rennwald (Hrsg.) (1991a): Die Schmetterlinge Baden-Württembergs. Bd. 1: Tagfalter 1. Stuttgart (Ulmer), 552 S.
Ebert, G. & E. Rennwald (Hrsg.) (1991b): Die Schmetterlinge Baden-Württembergs. Bd. 2: Tagfalter II. Stuttgart (Ulmer), 535 S.
Ebert, G. & H. G. Lussi (1994): Procridinae. In: Ebert, G., Esche, T., Herrmann, R., Hofmann, A., Lussi, H. G., Nikusch, I., Speidel, W., Steiner, A. & J. Thiele: Die Schmetterlinge Baden-Württembergs. Bd. 3: Nachtfalter I. Stuttgart (Ulmer), 153–195.
Fartmann, T. (1997): Biozönologische Untersuchungen zur Heuschreckenfauna auf Magerrasen im Naturpark Märkische Schweiz (Ostbrandenburg). Arbeiten a. d. Institut f. Landschaftsökologie, Westfälische Wilhelms-Universität Münster 3, 1–62.
Fartmann, T. (2002): Die Schmetterlingsgemeinschaften der Halbtrockenrasen-Komplexe des Diemeltales – Biozönologie von Tagfaltern und Widderchen in einer alten Hudelandschaft. Diss. Institut für Landschaftsökologie, Universität Münster, 156 S.
Fartmann, T. (i. Dr.): Die Schmetterlingsgemeinschaften der Halbtrockenrasen-Komplexe des Diemeltales – Biozönologie von Tagfaltern und Widderchen in einer alten Hudelandschaft. Abh. Westf. Mus. Naturkde. 65 (5).
Fartmann, T., Gunnemann, H., Salm, P. & E. Schröder (2001): Berichtspflichten in Natura-2000-Gebieten. Empfehlungen zur Erfassung der Arten des Anhangs II und Charakterisierung der Lebensraumtypen des Anhangs I der FFH-Richtlinie. Angewandte Landschaftsökologie 42, 725 S.
Fartmann, T & H. Mattes (1997): Heuschreckenfauna und Grünland – Bewirtschaftungsmaßnahmen und Biotopmanagement. Arbeiten a. d. Institut f. Landschaftsökologie, Westfälische Wilhelms-Universität Münster 3, 179–188.
Fartmann, T. Dudler, H. & W. Schulze (2002): Zur Ausbreitung des Kleinen Sonnenröschen-Bläulings Aricia agestis ([Denis & Schiffermüller], 1775) in Westfalen (Lep., Lycaenidae) - eine erste Übersicht. Mitteilungen der Arbeitsgemeinschaft westfälischer Entomologen 18 (2), 41-48.
Feldmann, R., Reinhardt, R. & J. Settele (1999): Bestimmung und Kurzcharakterisierung der außeralpinen Tagfalter Deutschlands. In: Settele, J., Feldmann, R. & R. Reinhardt (Hrsg.): Die Tagfalter Deutschlands. Stuttgart (Ulmer), 247–369.
Finck, P., Klein, M., Riecken, U. & E. Schröder (1998): Schutz und Förderung dynamischer Prozesse in der Landschaft. Schriftenr. Landschaftspflege Naturschutz 56, 425 S.
Finke, C. (1998): Jordanita subsolana (Staudinger, 1862) (Lep., Zygaenidae) im Diemeltal (Nordhessen). Mitt. Arbeitsgem. ostwestf.-lipp. Ent. 14 (1), 1–8.
Fuller, R. J. (1992): Effects of coppice management on woodland breeding birds. In: Fuller, R. J. & M. S. Warren (1993): Coppiced woodlands – their management for wildlife. London (Chapman & Hall), 169–192.
Gatter, W. (2000): Vogelzug und Vogelbestände in Mitteleuropa. 30 Jahre Beobachtung des Tagzugs am Randecker Maar. Wiebelsheim (Aula Verlag), 656 S.
Gemmeke, F. (1975): Chronik der Westfälischen Schafzucht. Paderborn, 103 S.
Gerken, B. & C. Meyer (1994): Kalkmagerrasen in Ostwestfalen. Über Pflege und Entwicklung der Kalkmagerrasen in Ostwestfalen, Kreise Höxter, Paderborn und Lippe. LÖBF-Mitteilungen 3, 32–40.
Glöckner, M. & T. Fartmann (2003). Die Tagschmetterlings- und Widderchenfauna der Briloner Hochfläche (Hochsauerlandkreis). Natur und Heimat 63 (3), 81-96.
Greatorex-Davies, J. N. & R. H. Marrs (1992): The quality of coppice woods as habitats for invertebrates. In: Fuller, R. J. & M. S. Warren (1993): Coppiced woodlands – their management for wildlife. London (Chapman & Hall), 271–296.
Grünwald, V. (1988): Mellicta aurelia aurelia (Nickerl, 1850) (= parthenie Borkhausen, 1788) – ein Neufund für Westfalen (Lep., Nymphalidae). Mitt. Arbeitsgem. ostwestf.-lipp. Ent. 4 (43), 125–130.
Harkort, W. (1975): Schmetterlinge in Westfalen (ohne Ostwestfalen) Fundortkarten und Fundortlisten (Stand: Ende 1974). Dortmunder Beitr. Landeskde. 9, 33–102.
Hattwig, M. (1993): Die Bedeutung der aufgelassenen Kalksteinbrüche im Raum Lengerich als Lebensraum für Schmetterlinge. Dipl.-Arb., Universität Münster, 98 S.
Hermann, G. (1999): Methoden der qualitativen Erfassung von Tagfaltern. In: Settele, J., Feldmann, R. & R. Reinhardt (Hrsg.): Die Tagfalter Deutschlands. Stuttgart (Ulmer), 124–143.
Hermann, G. & R. Steiner (2000): Der Braune Eichen-Zipfelfalter in Baden-Württemberg. Naturschutz u. Landschaftsplanung 32 (9): 271–277.
Hessische Gesellschaft für Ornithologie und Naturschutz e. V. (HGON) (1987): Biotopkataster der Trockenrasen (Magerrasen) des Landkreises und der Stadt Kassel und Randgebiete. Msk.
Hofmann, A. (1994): Zygaeninae. In: Ebert, G., Esche, T., Herrmann, R., Hofmann, A., Lussi, H. G., Nikusch, I., Speidel, W., Steiner, A. & J. Thiele: Die Schmetterlinge Baden-Württembergs. Bd. 3: Nachtfalter I. Stuttgart (Ulmer), 196–335.
Hozak, R. & C. Meyer (1998): Konzepte zur Wiederbelebung der Hüteschäferei auf Kalkmagerrasen und Heiden. LÖBF-Mitteilungen 4, 22–28.
Karsholt, O. & j. Razowski (1996): The lepidoptera of Europe. A distributional checklist. Apollo Books (Stenstrup), 380 S.
Kinkler, H. (1996): Wiedereinwanderung des Trauermantels Nymphalis antiopa (Linnaeus, 1758) ins nördliche Rheinland und ins westliche Westfalen (Lep., Nymphalidae). Melanargia 8 (1), 52–53.
Kockelke, K., Hermann, G, Kaule, G, Verhaagh, M. & J. Settele (1994): Zur Autökologie und Verbreitung des Kreuzenzian-Ameisenbläulings, Maculinea rebeli (Hirschke, 1904). Carolinea 52, 93–109.
Kratochwil, A. & A. Schwabe (2001): Ökologie der Lebensgemeinschaften. Stuttgart (Verlag Eugen Ulmer), 756 S.
Lucan, V. & W. Eger (1996): Der Einfluss des Menschen auf die Pflanzendecke. In: Becker, W., Frede, A. & W. Lehmann (Hrsg.): Pflanzenwelt zwischen Eder und Diemel. Flora des Landkreises Waldeck-Frankenberg mit Verbreitungsatlas. Naturschutz in Waldeck-Frankenberg 5, 46–53.
Meineke, T. (1986): Schmetterlinge (Insecta, Lepidoptera) zweier südexponierter Kalk-Hangbuchenwälder im Landkreis Göttingen (Niedersachsen). Mitt. Fauna Flora Südniedersachsens 8, 1–14.
Michels, C. & M. Woike (1994): Schafbeweidung und Naturschutz. Pflege von Heiden, Mooren, Kalkmagerrasen und Grünlandflächen. LÖBF-Mitteilungen 19 (3), 16–25.
Naumann, C. M., Tarmann, G. M. & W. G. Tremewan (1999): The western palaearctic zygaenidae. Stenstrup (Apollo Books), 304 S.
Nitsche, S. & M. Bultmann (1995): Magerrasen und Heiden im Raum Kassel. Naturschutz i. Hessen, Sonderheft 1, 108 S.
Parmesan, C., Ryrholm, N., Stefanescu, C., Hill, J. K., Thomas, C. D., Descimon, H., Huntley, B., Kaila, L. , Kullberg, J., Tammaru, T., Tennant, J., Thomas, J. A. & M. S. Warren (1999): Poleward shifts in geographical ranges of butterfly species associated with regional warming. Nature 399, 579–583.
Projektgruppe Halbtrockenrasen (1993): Pflege und Entwicklung der Kalkmagerrasen als Beitrag zur Kulturlandschaftspflege in Ostwestfalen (Kreise Höxter, Lippe und Paderborn). Abschlußbericht. Msk., 263 S.
Quinger, B., Bräu, M. & M. Kornprobst (1994): Lebensraumtyp Kalkmagerrasen. 1. und 2. Teilbd. Landschaftspflegekonzept Bayern, Bd. II.1. München, 266 und 317 S.
Reinhardt, R. & J. Settele (1999): Arteninventar, Verbreitung und Gefährdungseinstufung. In: Settele, J., Feldmann, R. & R. Reinhardt (Hrsg.): Die Tagfalter Deutschlands. Stuttgart (Ulmer), 18–33.
Rengelshausen, B. (1997): Die Fragmentierung von Kalkmagerrasen und die Folgen für Tagfalter und Widderchen. Dipl.-Arb., Universität Göttingen, 80 S.
Retzlaff, H. (1972): Zur Einwanderung und Ausbreitung von Agrumenia carniolica modesta Bgff. (Lep. Zyg.) im südöstlichen Weserbergland. Ein Beitrag zur Schmetterlingsfauna in Ostwestfalen-Lippe. Mitt. Arbeitsgem. ostwestf.-lipp. Ent. 1(16), 1–8.
Retzlaff, H. (1973): Die Schmetterlinge von Ostwestfalen-Lippe und einigen angrenzenden Gebieten Hessens und Niedersachsens (Weserbergland, südöstliches Westfälisches Tiefland und östliche Westfälische Bucht). I. Teil. Ber. d. Naturw. Ver. Bielefeld 21, 129–248.
Retzlaff, H. (1975): Die Schmetterlinge von Ostwestfalen-Lippe und einigen angrenzenden Gebieten Hessens und Niedersachsens (Weserbergland, südöstliches Westfälisches Tiefland und östliche Westfälische Bucht). II. Teil. Ber. d. Naturw. Ver. Bielefeld 22, 199–344.
Retzlaff, H. (1981): Nachtrag zu »Die Schmetterlinge von Ostwestfalen-Lippe und einigen angrenzenden Gebieten Hessens und Niedersachsens«. Fortsetzung. Mitt. Arbeitsgem. ostwestf.-lipp. Ent. 24, 21–28.
Reuhl, H. (1972): Die Großschmetterlinge („Macrolepidoptera“) Nordhessens. I. „Diurna“ (Tagfalter), 1. „Rhopalocera“ (Echte Tagfalter) und Hesperiidae (Dickkopffalter). Philippia 1 (4), 215–230.
Reuhl, H. (1973): Die Großschmetterlinge („Macrolepidoptera“) Nordhessens. II. „Heterocera“ (Nachtfalter), 1. Bombyces (Spinner) und Sphinges (Schwärmer). Philippia 1 (5), 271–285.
SBN (Schweizerischer Bund für Naturschutz, Lepidopterologen-Arbeitsgruppe) (Hrsg.) (1987): Tagfalter und ihre Lebensräume. Arten, Gefährdung, Schutz. Egg/ZH (Fotorotar AG), 516 S.
SBN (Schweizerischer Bund für Naturschutz, Lepidopterologen-Arbeitsgruppe) (Hrsg.) (1997): Schmetterlinge und ihre Lebensräume. Arten, Gefährdung, Schutz. Egg/ZH (Fotorotar AG), 679 S.
Schmidt, M. (2000): Die Blaugras-Rasen des nördlichen deutschen Mittelgebirgsraumes und ihre Kontaktgesellschaften. Berlin, Stuttgart (Cramer), Diss. Bot. 328, 294 S.
Schubert, W. (1989a): Kiefern kontra Knabenkräuter – Entstehung, Gefährdung, Schutz und Pflege der Marsberger Kalkhalbtrockenrasen. Marsberg 89, 84–87.
Schubert, W. (1989b): Planung und Aufbau eines Biotopverbundsystems Kalkhalbtrockenrasen Marsberger Hochfläche (Hochsauerlandkreis). Msk., 321 S.
Schubert, W. (1994): Länderübergreifendes Beweidungskonzept mit Rhönschafen realisiert. LÖBF-Mitteilungen 3, 48–51.
Schulze, W. (1995): Bemerkenswerte Tagfalternachweise in Ostwestfalen (Lep., Papilionidae, Pieridae, Nymphalidae). Mitt. Arbeitsgem. Ostwestf.-lipp. Ent. 11 (3), 100–103.
Schulze, W. (1996): Mitteilungen zur Insektenfauna Westfalens VII (Lep., Nymphalidae, Lycaenidae; Col., Eucnemidae, Tenebrionidae, Scarabaeidae). Mitt. Arbeitsgem. Ostwestf.-lipp. Ent. 12 (3), 75–84.
Schuhmacher, O. & T. Fartmann (2003): Offene Bodenstellen und eine heterogene Raumstruktur - Schlüsselrequisiten im Lebensraum des Warzenbeißers (Decticus verrucivorus). Articulata 18 (1), 71-93.
Schumacher, W. (1991): Magerrasen. In: Forschungsgesellschaft Landschaftsentwicklung und Landschaftsbau e. V. (FLL) (Hrsg.). Biotoppflege, Biotopentwicklung und Maßnahmen zur Stützung und Initiierung von Lebensräumen für Tiere und Pflanzen. Teil 1. Dokumentation des Symposiums am 5. November 1990 in Bonn, 67–77.
Schumacher, W., Münzel, M. & S. Riemer (1995): Die Pflege der Kalkmagerrasen. In: Beinlich, B. & H. Plachter (Hrsg.) (1995): Schutz und Entwicklung der Kalkmagerrasen der Schwäbischen Alb. Veröff. Naturschutz Landschaftspflege Bad.-Württ., Beih. 83, 37–63.
Settele, J. & R. Reinhardt (1999): Ökologie der Tagfalter Deutschlands: Grundlagen und Schutzaspekte. In: Settele, J., Feldmann, R. & R. Reinhardt (Hrsg.) (1999): Die Tagfalter Deutschlands – Ein Handbuch für Freilandökologen, Umweltplaner und Naturschützer. Stuttgart (Eugen Ulmer-Verlag), 60–123.
Siebers, J. (1911): Marsberg zur Zeit des Dreißigjährigen Krieges. Diss., Universität Münster.
Sonnenburg, F. & T. Kordges (1997): Zur Verbreitung und Gefährdungssituation von Maculinea nausithous Bergsträsser, 1779 und Maculinea teleius Bergsträsser, 1779 in Nordrhein-Westfalen (Lepidoptera: Lycaenidae). Decheniana 150, 293–307.
Speyer, Ad. (1867): Die Lepidopterenfauna des Fürstentums Waldeck. Verh. nat. hist. Ver. preuß. Rheinl. Westfalens 24, 147–298.
Ssymank, A., Hauke, U., Rückriem, C. & E. Schröder (1998): Das europäische Schutzgebietssystem NATURA 2000 – BfN-Handbuch zur Umsetzung der Fauna-Flora-Habitat-Richtlinie und der Vogelschutz-Richtlinie. Schriftenr. f. Landschaftspflege u. Naturschutz 53, 560 S.
Thomas, C. D. (1995): Ecology and conservation of butterfly metapopulations in the fragmented British landscape. In Pullin, A. S. (Hrsg.): Ecology and conservation of Butterflies. London (Chapman & Hall), 46–68.
Thomas, J. A. (1993): Holocene climate change and warm man-made refugia may explain why a sixth of British butterflies inhabit innatural early-successional habitats. Ecography 16, 278–284.
Thomas, J. A. & M. G. Morris (1994): Patterns, mechanisms and rates of extinction among invertebrates in the United Kingdom. Phil. Trans. R. Soc. London B, 344, 47–54.
Uffeln, K. (1908): Die Großschmetterlinge Westfalens mit besonderer Berücksichtigung der Gegenden von Warburg, Rietberg und Hagen. Jahresber. Zool. Sekt. Westf. Prov.-Ver. Wiss. Kunst, Beih., 1–158.
Uffeln, K. (1914): Die Großschmetterlinge Westfalens. Nachträge und Berichtigungen. Jahresber. Westf. Prov.-Ver. Wiss. Kunst 42, 41–95.
Uffeln, K. (1926): Die Großschmetterlinge Westfalens. III. Nachtrag. Jahresber. Westf. Prov.-Ver. Wiss. Kunst 50–52, 156–174.
van Swaay, C. A. M. (2002): The importance of calcareous grasslands for butterflies in Europe. Biol. Cons., 104, 315–318.
WallisDeVries, M. F., Poschlod, P. & J. W. Willems (2002): Challenges for the conservation of calcareous grasslands in Northwestern Europe: integrating the requirements of flora and fauna. Biol. Cons. 104, 265–273.
Warren, M. S. (1996): Giant step to save woodland butterflies: the coppice for butterflies challenge. Butterfly Conservation News 63, 18–20.
Warren, M. S. & D. E. A. Stephens (1989): Habitat design and management for butterflies. The Entomologist 108 (1/2), 123–134.
Warren, M. S. & J. A. Thomas (1992): Butterfly responses to coppicing. In: Buckley, G. P. (Hrsg.): Ecology and management of coppice woodlands. London (Chapman & Hall), 249–270.
Weber, T. & A. Weidner (1995): Ökologische und faunistische Untersuchungen der tagaktiven Schmetterlinge. Beitrag zum Pflege- und Entwicklungsplan »Ahr 2000«. Msk. 69 S.
Weidemann, H. J. (1995): Tagfalter: beobachten, bestimmen. 2. Aufl., Augsburg (Naturbuch-Verlag), 659 S.
Weigt, H.-J. (1982): Lepidoptera Westfalica. Abh. a. d. Westf. Mus. f. Naturkde. 44 (1), 3–111.
Wilke, E. (1996): Entwicklung der Schäferei in Hessen und Aspekte der Beweidung. Jahrbuch Naturschutz i. Hessen 1, 86–89.
Woike, M. & P. Zimmermann (1994): Biotope pflegen mit Schafen. AID-Broschüre (Auswertungs- und Informationsdienst f. Ernährung, Landwirtschaft u. Forsten), Bonn.
Wynhoff, I., van der Made, J. & C. van Swaay (1992): Dagvlinders van de Benelux. 2e druk, Utrecht (Stichting Uitgeverij KNNV), 188 S.
Dr. Thomas Fartmann
Westfälische Wilhelms-Universität Münster
Institut für Landschaftsökologie
AG Biozönologie
Robert-Koch-Str. 26
48149 Münster
E-Mail: fartmann@uni-muenster.de
---------------------------------------
1 Veränderte und aktualisierte Version des gleichnamigen Artikels aus Irrgeister 2003, 19. Jhg., Heft 1, S. 20–44, unter besonderer Berücksichtigung des Mittleren Diemeltales.
2 Eine Metapopulation besteht aus lokalen Teilpopulationen, die durch Kolonisten in Verbindung stehen und durch immer wiederkehrende Aussterbe- und Besiedlungsprozesse gekennzeichnet sind. Keine einzelne Teilpopulation ist groß genug, um das Überleben der Metapopulation alleine zu sichern.